MADRID, 27 (EUROPA PRESS)
Philips ha recibido la aprobación de la Agencia de Medicamentos y Alimentación de Estados Unidos (FDA, por sus siglas en inglés) para su biosensor portátil 'Philips Biosensor BX100' para ayudar a la gestión de pacientes confirmados y sospechosos del COVID-19 en el hospital.
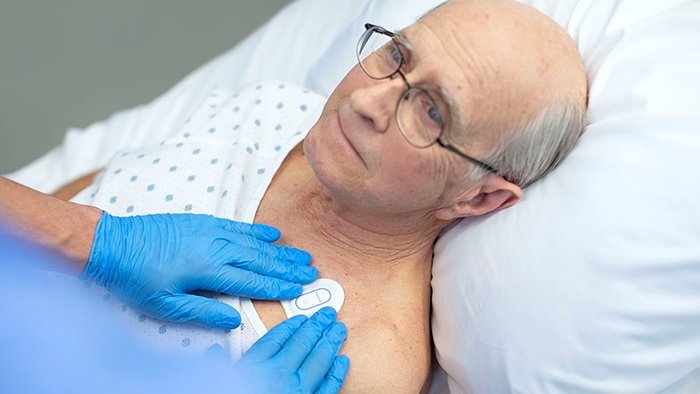
El biosensor inalámbrico portátil mejora la vigilancia clínica a través de la solución de detección de deterioro de pacientes de Philips y ayuda a los profesionales sanitarios a detectar riesgos para que puedan intervenir antes y, de esta manera, mejorar la atención de pacientes en áreas de cuidados críticos. La solución, que ya recibió la marca CE y que se encuentra disponible en España, actualmente está en uso a través de la primera instalación en el Hospital OLVG en Países Bajos, ayudando a gestionar el triaje y la vigilancia clínica de los pacientes con la COVID-19.
El 'Biosensor BX100' de Philips está diseñado para abordar un nuevo enfoque de las mediciones de los signos vitales, apoyando la vigilancia de pacientes críticos que se trasladan de unidades de cuidados intensivos a áreas de cuidados generales de un hospital. Liviano y desechable, es un parche portátil de un solo uso durante cinco días que se puede integrar con un centro escalable para monitorear múltiples pacientes en diferentes habitaciones.
Diseñado para incorporarse a los flujos de trabajo clínicos existentes para visualización y notificaciones en móviles, el dispositivo no requiere limpieza ni carga. Destinado a ser utilizado en pacientes mayores de 18 años, se adhiere discretamente al pecho para recoger, almacenar, medir y transmitir la frecuencia respiratoria y la frecuencia cardíaca cada minuto: los dos principales predictores de deterioro, así como parámetros contextuales como la postura, el nivel de actividad y la deambulación.

